Kadaise, antikiniame pasaulyje, žmonės galvojo, kad viskas yra sudaryta iš keturių pirmapradžių elementų – žemės, oro, ugnies ir vandens (dar kartais būdavo pridedamas eteris). Viduramžiais alchemikai tikėjo, kad teisingai sumaišius sierą ir gyvsidabrį, galima gauti bet kokią kitą medžiagą (svarbiausiai, aišku, auksą). Devynioliktame amžiuje pradėjo aiškėti, kad įvairios medžiagos viena nuo kitos gali skirtis labai fundamentaliai – fizikinėmis ir cheminėmis savybėmis. Po truputį, Dmitrijaus Mendelejevo ir kitų mokslininkų dėka, sudaryta ir užpildyta periodinė cheminių elementų lentelė, išrikiuojanti visus pirmapradžius elementus – o jų gamtoje sutinkami net 90 skirtingų – į grupes ir periodus. Bet kad jau turime tokią įvairovę, verta paklausti, o kodėl tiek daug tų elementų egzistuoja ir kaip jie atsiranda?
Lentelė
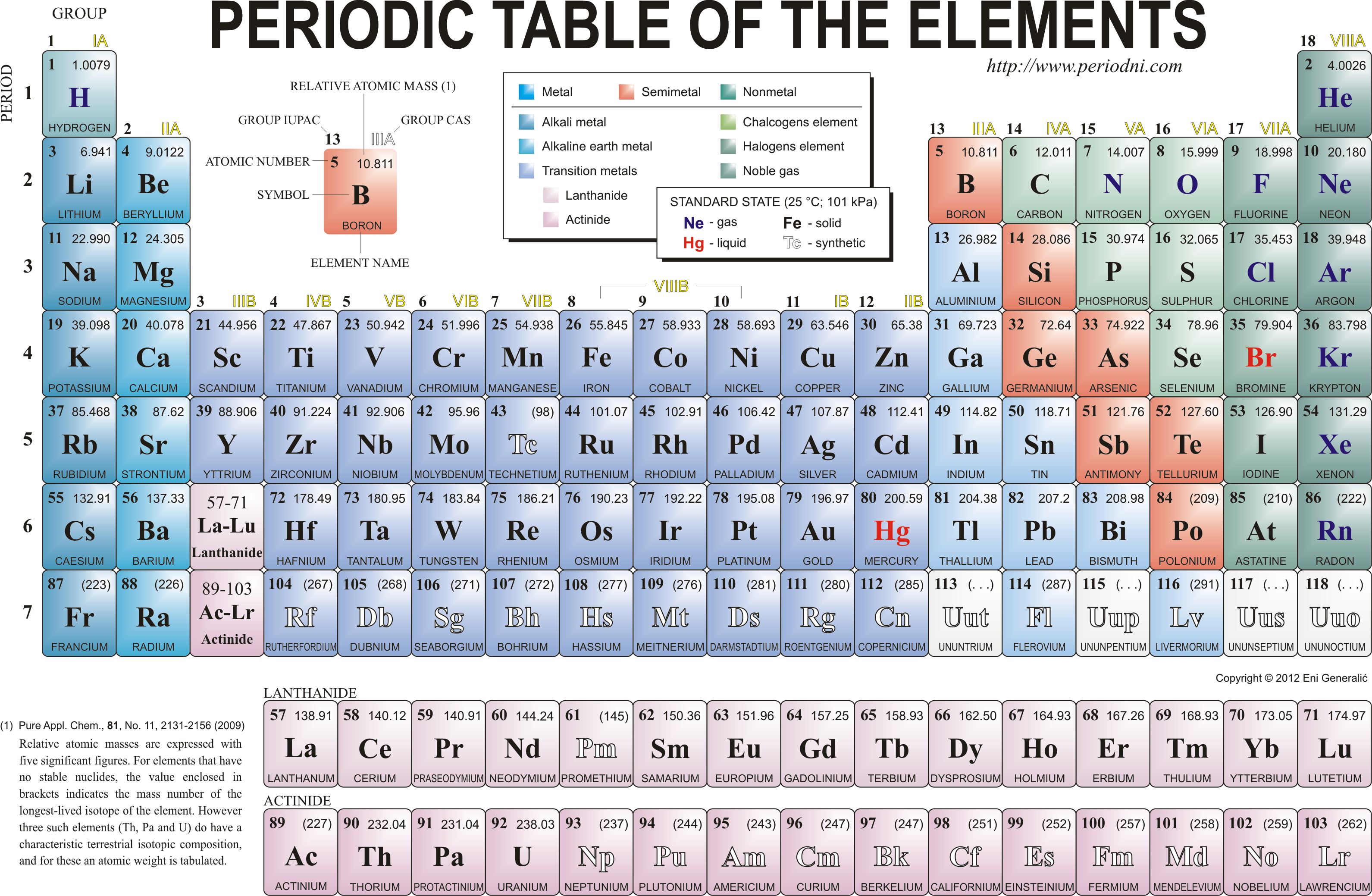
Pradėkime nuo to, kaip reikia skaityti periodinę elementų lentelę ir ką reiškia elemento padėtis joje. Kiekvienas cheminis elementas, kiekvienas atomas, gali būti aprašytas dviem skaičiais. Tie skaičiai yra atominis skaičius (arba numeris) ir atominė masė; jie nurodo atomo branduolio sudėtį. Atominis skaičius parodo, kiek protonų yra elemento branduolyje, kartu taip nurodomas ir branduolio elektrinis krūvis (kiekvienas protonas turi po tokį patį teigiamą krūvį, lygų $$1,6 \times 10^{-19}$$ kulono). Atominė masė yra viso branduolio masė, išreikšta atominiais masės vienetais (a.m.v.; vienas a.m.v. yra maždaug lygus protono arba neutrono masei, t.y. $$1,7 \times 10^{-27}$$ kg). Ši masė yra truputį mažesnė, negu atskirai paimtų branduolį sudarančių protonų ir neutronų masių suma; skirtumas tarp šių dviejų masių, vadinamas masės deficitu, nurodo branduolį laikančią ryšio energiją – tiek papildomai energijos reikėtų suteikti branduoliui, kad jis išsilakstytų į sudedamąsias dalis. Toji ryšio energija yra labai naudingas dalykas – du protonai ir du neutronai, susijungdami į helio atomą, išspinduliuoja labai daug energijos (pavertus kasdieniniais vienetais, tai būtų apie 175 gigavatvalandės iš vieno medžiagos kilogramo, arba maždaug savaitė Lietuvos elektros energijos sąnaudų); tas procesas vadinamas branduoline sinteze ir, jei pavyktų jį suvaldyti, galėtų labai sėkmingai patenkinti žmonijos energijos poreikius. Bet čia jau lyrinis nukrypimas.
Kiekvienas cheminis elementas nuo kitų skiriasi savo atominiu skaičiumi. Vandenilio atominis skaičius yra vienas; tai reiškia, kad jei elemento atominis skaičius yra vienas, tas elementas yra vandenilis. Analogiškai helio skaičius yra du, ličio – trys, ir taip toliau. Tuo tarpu tas pats elementas gali turėti keletą atmainų su skirtingomis atominėmis masėmis; tos atmainos vadinamos izotopais. Pavyzdžiui, vandenilio pagrindinė atmaina yra tokia, kurios branduolį sudaro vienas vienintelis protonas ir daugiau nieko; šitokio vandenilio (dar kartais vadinamo pročiu) atominė masė irgi yra vienetas (na, ji nuo vieneto skiriasi, jei žiūrime į keletą skaičių po kablelio, bet nežymiai). Dar vandenilis turi dvi kitas atmainas – deuterį (branduolyje vienas protonas ir vienas neutronas) bei tritį (vienas protonas ir du neutronai). Helio pagrindinė atmaina yra helis-4 (du protonai ir du neutronai, masė ~4, todėl ir pavadinime ketvertas), bet būna ir helis-3, ir helis-5. Analogiškai ir su kitais elementais. Daugelis elementų turi po vieną pagrindinį izotopą (pvz. anglis-12 ar deguonis-16) bei keletą kitų – ir stabilių (pvz. deguonis-17 ir -18), ir radioaktyvių (pvz. anglis-14, naudojama radioaktyviajam archeologinių radinių datavimui).
Periodinės lentelės periodai ir grupės prasmę įgyja tada, kai nuo branduolių pereiname prie visų atomų, t.y. pridedame elektronus. Kiekvienas cheminis elementas turi neutralią konfigūraciją, kai aplink branduolį pasklidę tiek elektronų, kiek branduolyje yra protonų. „Pasklidę“ rašau todėl, kad elektronas atome yra ne mažytis rutuliukas, besisukantis aplink branduolį, o krūvis, pasklidęs erdvėje pagal tam tikrą tikimybių skirstinį. Bet čia vėl lyrinis nukrypimas. Elektronai yra išsidėstę ne bet kaip, o vadinamose orbitalėse (pavadinimas vėlgi atėjęs iš tų laikų, kai atomas buvo įsivaizduojamas kaip mažytė Saulės sistema). Orbitalės yra skirtingų dydžių (žymimų raide n), formų (l) ir krypčių (m, jei forma nesimetriška). Kiekvienas orbitalės dydis ir forma turi skirtingą energijos lygį – tai toks įdomus kvantinis reiškinys, neleidžiantis elektronui nukristi į branduolį; elektronas atome gali turėti tik griežtai apibrėžtus energijos kiekius; jie visi yra neigiami, nes elektronai pririštas prie branduolio; žemiausias energijos lygmuo yra pririštas tvirčiausiai, o surišimui silpnėjant, lygmenys išsidėstę vis tankiau vienas prie kito. Konkrečios energijos vertės priklauso nuo branduolio savybių; vandenilio (pročio) atome žemiausias energijos lygmuo yra -13,6 elektronvolto (eV; vienas eV yra lygus elektrono krūviui, padaugintam iš vieno volto įtampos – iš čia ir pavadinimas – ir lygus $$1,6 \times 10^{-19}$$ džaulio), antras žemiausias – keturis ($$2^2$$) kartus mažesnis, trečias – devynis ($$3^2$$) kartus mažesnis ir taip toliau.
Kiekvieno energijos lygmens orbitalių skaičius irgi yra nevienodas. Pirmo (žemiausio, n = 1) lygio orbitalė yra tik viena, sferinė (l = 0). Antro lygio (n = 2) – keturios ($$2^2$$), sferinė ir trys aštuoniukės formos (l = 1; viena kitai statmenos, m = -1, 0 ir 1). Trečio lygio – devynios ($$3^2$$), sferinė, trys aštuoniukės ir penkios dar sudėtingesnės (l = 2, m nuo -2 iki 2; žr. paveiksliuką žemiau). Į vieną orbitalę telpa du elektronai. Kodėl du? Todėl, kad kvantinės mechanikos dėsniai neleidžia dviems vienodiems elektronams būti ten pat, o elektronai, esantys atome, vienas nuo kito skiriasi orbitalės dydžiu, orbitalės forma, kryptimi ir dar viena savybe, vadinama sukiniu arba spinu (žymima raide s). Sukinio vertės gali būti „aukštyn“ arba „žemyn“, taigi ir turime du elektronus vienai orbitalei. Atomo neutralioje konfigūracijoje elektronai užpildo orbitales nuo žemiausio energijos lygmens aukštyn. Jei elektronų trūksta, atomas yra teigiamai jonizuotas, jei elektronų per daug – neigiamai jonizuotas. Jei elektronai yra užpildę kurias nors aukštesnes orbitales, o žemiau esančios yra tuščios, atomas vadinamas sužadintu, bet paprastai tokioje būsenoje ilgai neišsilaiko – elektronai nukrenta žemyn į tuščias orbitales ir išspinduliuoja atitinkamos energijos fotonų.

Dabar, žinodami apie orbitales ir elektronų išsidėstymą atomuose, galima užpildyti ir periodinę lentelę. Pirmasis jos periodas sudarytas iš elementų, kurių pagrindinėse konfigūracijose elektronų yra tik orbitalėje n = 1. Tokių elementų yra tik du – vandenilis (vienas elektronas) ir helis (du elektronai). Antrojo periodo elementai elektronų turi jau ir n = 2 orbitalėse – čia galimi aštuoni variantai (keturios orbitalės po du elektronus). Analogiškai trečiajame periode būtų galima tikėtis rasti 18 elementų, bet ten jų yra tik aštuoni. Kodėl? Ogi todėl, kad n = 3, l = 2 orbitalių energija yra didesnė, nei n = 4, l = 0, tad užsipildo vėliau. Vadinasi trečiasis periodas sudarytas iš elementų, kuriuose elektronai pildo n = 3, l = 0, 1 orbitales, o n = 3, l = 2 orbitalės pildomos jau ketvirtajame periode, kur tikrai randame 18 elementų. Penktajame periode pildomos n = 4, l = 2 orbitalės, o šeštajame – jau ir n = 4, l = 3; šie keturiolika elementų, vadinamų lantanoidais (nes pirmasis iš jų yra lantanas), paprastai pateikiami periodinės lentelės apačioje. Septintajame periode pildomos n = 6, l = 2 ir n = 5, l = 3 orbitalės (pastarieji keturiolika elementų vadinami aktinoidais). Aštuntojo periodo kol kas nepasiekėme.
Periodinės lentelės grupės nurodo, kiek elektronų yra išoriniame jų sluoksnyje (šie elektronai vadinami valentiniais, nes tik jie dalyvauja cheminėse reakcijose). Pirmos grupės elementai turi vieną elektroną, antros – du ir taip toliau. Paskutinės, aštuntos, grupės elementų išorinis sluoksnis yra visai užpildytas, todėl jie su kitais elementais reaguoja silpnai – ne veltui tie elementai vadinami inertinėmis dujomis.
Nukleosintezė
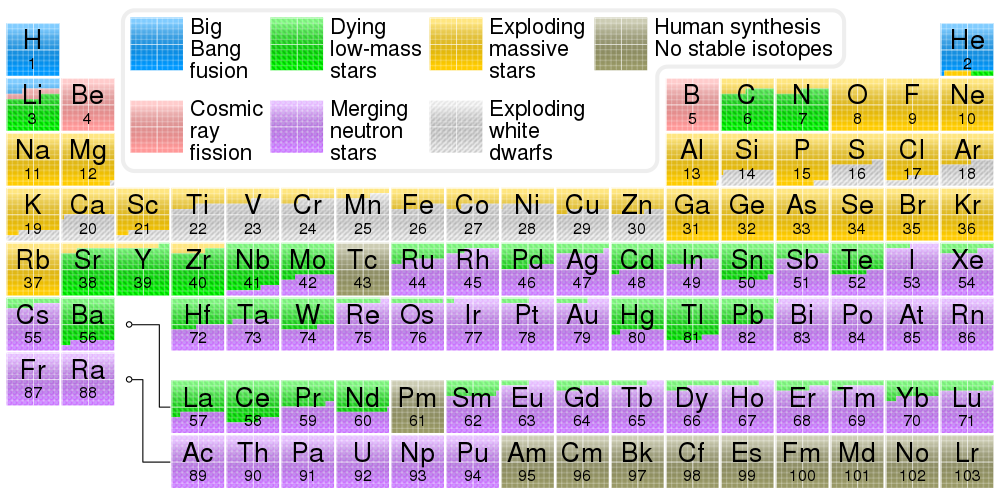
Na štai, tikiuosi, kad pasakojimas apie periodinę lentelę ir cheminių elementų sandarą labai nenusibodo. Dabar galima pakalbėti ir apie tai, iš kur tie elementai atsirado. Juk gamtoje aptinkami visi elementai nuo pirmojo (vandenilio) iki 92-ojo (urano), išskyrus du – technecį ir prometį; dauguma elementų turi po kelis natūralius ir visą pulką sintetinių izotopų. Laboratorijoje sukurta ir sunkesnių elementų, šiuo metu sunkiausias yra berods 118-asis (kol nepaskirtas oficialus pavadinimas, laikinas yra ununoktis).
Cheminių elementų susidarymas vadinamas nukleosinteze. Ji prasidėjo netrukus po to, kai atsirado Visata. Pirmosiomis sekundėmis temperatūra ir tankis ten buvo pakankamai dideli, kad vyko įvairios branduolinės reakcijos. Jų metu iš pradžių kvarkai (tokios elementariosios dalelės) susijungė į protonus ir neutronus, o vėliau dalis protonų ir neutronų susijungė į įvairius vandenilio, helio ir ličio izotopus. Daugiau cheminių elementų pirmykštėje Visatoje nebuvo. Iki jų atsiradimo teko laukti milijonus metų, kol užsižiebė pirmosios žvaigždės.
Žvaigždėse medžiaga – plazma – suspausta iki tokių tankių ir temperatūrų, kad prasideda termobranduolinės reakcijos. Jų metu vandenilis jungiasi į helį, taip daugėja helio ir mažėja vandenilio. Vėliau, kai žvaigždės branduolyje (kur vyksta didžioji reakcijų dalis) sudega didžioji dalis vandenilio, prasideda helio degimas. Helio degimo reakcija yra tokia: trys helio branduoliai susijungia į anglies branduolį. Iš principo įmanomas ir dviejų helio branduolių jungimasis į berilį, bet berilis labai greitai pagauna dar vieną helį ir virsta anglimi, taigi bendras reakcijos produktas vis tiek yra anglis. Helio degimo produktai gali degti ir toliau – tai vadinama alfa procesu (nes helio branduolys dar vadinamas alfa dalele). Prie anglies prisijungus dar vienam heliui, atsiranda deguonis. Pridedame dar vieną helį ir turime neoną. Paskui magnį. Ir taip toliau. Nelabai masyviose žvaigždėse kažkur čia tas procesas ir baigiasi – lieka baltoji nykštukė, kurioje termobranduolinės reakcijos nebevyksta. Dažniausiai tos nykštukės sudarytos iš anglies ir deguonies, bet būna ir deguonies-neono bei netgi neono-magnio baltųjų nykštukių. Masyvesnėse žvaigždėse degimas tęsiasi iki 26-ojo elemento, geležies. Tęsiasi jis todėl, kad degimo metu išsiskirianti energija sukuria pakankamą slėgį, kuri vis dar gali palaikyti žvaigždę nekolapsuojančią. Tačiau gaminant sunkesnius už geležį elementus energija jau nebe išskiriama, o sugeriama; kitaip tariant, norint prie geležies prijungti dar vieną helio branduolį reikia sunaudoti daugiau energijos, nei išskiriama susijungimo metu. Tokios reakcijos nesulaiko žvaigždės nuo kolapso ir įvyksta supernovos sprogimas. Bet tai nereiškia, kad reakcijos nevyksta – sprogimo metu išsiskiria pakankamai energijos, kad elementai jungtųsi toliau. Taip susiformuoja už geležį sunkesni cheminiai elementai, o bendras juos formuojančių reakcijų pavadinimas yra r-procesas.
Kodėl „r“? Todėl, kad procesas yra greitas (rapid). Yra ir alternatyva – s-procesas (slow), vykstantis žvaigždžių atmosferose. Jo metu taip pat susiformuoja sunkūs cheminiai elementai, bet jis vyksta lėčiau. Visgi abiejų procesų esmė yra panaši – jie remiasi neutronų pagavimu. Cheminis elementas arba jo branduolys prisijungia neutroną (r-proceso atveju tai vyksta dažnai, branduolys yra bombarduojamas energingais neutronais, s-proceso metu – lėtai, gal sykį per šimtą metų vienam konkrečiai paimtam branduoliui) arba kelis, tampa nestabilus ir jame įvyksta beta skilimas. Beta skilimo metu neutronas virsta protonu, o iš sistemos išspinduliuojamas elektronas ir elektroninis antineutrinas. Taigi staiga branduolyje atsirado vienu protonu daugiau – turime vienetu didesnio atominio skaičiaus elementą. Ir s-, ir r-procesas sukuria maždaug po pusę už geležį sunkesnių cheminių elementų (nors kiekvieno atskiro elemento sukūrimui abu procesai įtakos turi nevienodai).

Pastabus skaitytojas šioje vietoje turbūt krapštosi pakaušį ir galvoja, kodėl praleidau maždaug pusę elementų, lengvesnių už geležį, t.y. tų elementų, kurių atominis skaičius nelyginis. Juk jei pagrindinis elementų gamybos būdas yra helio prisijungimas, tai iš kur atsiranda, pavyzdžiui, boras (penktas elementas) ar azotas (septintas)? Kai kurie iš šių elementų, ypač sunkesni už anglį, susiformuoja r- ir s- procesų metu, nes šie procesai vyksta aplinkose, kuriose yra ne tik geležies, bet ir lengvesnių helio degimo produktų. Kai kurie elementai, pavyzdžiui natris, susidaro žvaigždės evoliucijos metu, degant kitiems alfa proceso produktams. Pavyzdžiui, du anglies branduoliai gali susijungti ir suformuoti neoną (plius išspinduliuojamas helio branduolys), natrį (plius išmetamas protonas) arba magnį. Deguonis irgi dega panašiai, ir gali suformuoti silicį, fosforą ir sierą. Aliuminis susidaro, kai magnis pagauna laisvą protoną. O lengvieji litis, berilis ir boras susiformuoja jau ne žvaigždėse, o tarpžvaigždinėje erdvėje, kai kosminiai spinduliai (didelės energijos dalelės) suskaldo masyvesnių elementų, dažniausiai deguonies ir azoto, branduolius.
Pabaiga
Visi šie procesai – Didžiojo sprogimo nukleosintezė, žvaigždžių evoliucija, supernovos, kosminiai spinduliai – suformuoja cheminių elementų įvairovę, kurią matome aplink save. Tiesa, Visatoje vis tiek daugiausiai vis dar yra vandenilio – apie 75%. Antras yra helis – apie 23%. Visi kiti cheminiai elementai sudaro vos 2% Visatos regimosios medžiagos masės. Tolimoje ateityje šių elementų masės dalis vis didės, o vandenilio ir helio – mažės. Kada nors balansas pasikeis tiek, kad naujos žvaigždės formuotis nebegalės, bet tai įvyks po daugybės trilijonų metų.
Laiqualasse

Ačiū. Labai įdomu straipsnis. Beje manau, kad raudau tekste porą klaidelių. Šiuose sakinuose:
Helio degimo reakcija yra tokia: trys helio branduoliai susijungia į geležies branduolį.
Masyvesnėse žvaigždėse degimas tęsiasi iki 26-ojo elemento, anglies.
Ar juose nereikia sukeisti vietomis anglies ir geležies?
Taip ir būna, kai rašai kažką naktimis… Ačiū, tuoj pataisysiu.
Geras straipsnis – vienoje vietoje surinkta esmė.
Pataisymai:
perdiodo -> periodo
kurit vis dar -> kurį vis dar
Vandenilis ir helis pagrinde susiformavo Didžiojo sprogimo metu.
->
Didžioji vandenilio ir helio dalis susiformavo per Didįjį sprogimą.
Vėlesni elementai formuojasi žvaigždėse degimo metu (geltona) arba s-proceso dėka (žalia) ir supernovose (oranžinė)
->
Kitus elementus formuoja degdamos žvaigždės (geltona) arba s-procesas (žalia) ir supernovos (oranžinė)
Ačiū, pataisiau.
Ačiū, pataisiau. Būna ir tokių žioplų klaidelių, kai pirštai pinasi :)
Žiauriai geras straipsnis :)
Čia galbūt per mano newbie’iškus klausimus šitą parašyti kilo mintis? :p
Taip, tamstos klausimas pakišto tokią mintį :) Bet klausimas ne newb’iškas, o labai geras. Štai apie ličio/berilio/boro atsiradimą ir pats nežinojau iki šio straipsnio rašymo.